NATRIUMBICARBONAAT
De stof natriumbicarbonaat is in staat te binden met zure afvalstoffen om deze te neutraliseren. Zo vormt natriumbicarbonaat een basische buffer in ons bloed. Deze stof is daarom essentieel voor het zuur-base-evenwicht omdat de buffer kan ingrijpen als het bloed te zuur wordt. Uw bloed moet namelijk een constante pH-waarde hebben van 7.365 (tussen de 7.35 en7.45).

Basische buffers zijn bicarbonaat (HCO3-) gepaard met basische mineralen. Voorbeelden daarvan zijn natriumbicarbonaat (NaHCO3), kaliumbicarbonaat (KHCO3), calciumbicarbonaat (Ca(HCO3)2) en magnesiumbicarbonaat (Mg(HCO3)2). De zure buffer is vooral koolzuur (H2CO3), een combinatie van water (H2O) en kooldioxide (CO2), die ontstaan uit volledig verbrande koolhydraten. Deze stoffen zijn altijd voldoende voorradig in het lichaam en om deze reden is er geen tekort aan zure buffer.
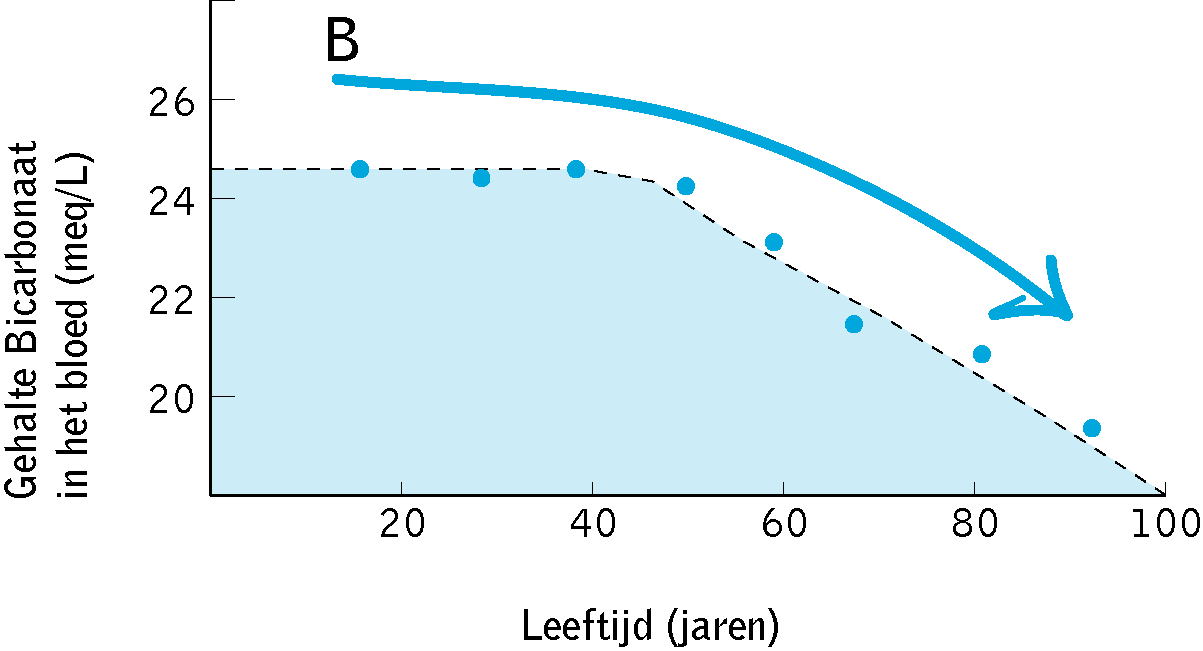
In 1996 ontdekte dr. Lynda Frassetto aan de Universiteit van Californië, San Francisco, dat als we ouder worden (vanaf de leeftijd van 45) we de basische buffer van bicarbonaten verliezen in ons bloed. Op de leeftijd van 90 verliezen we 18% van de bicarbonaten in ons bloed. Een onvoldoende hoeveelheid bicarbonaten in ons bloed vermindert ons vermogen om het zuur dat ons lichaam produceert te beheren (neutraliseren en afvoeren).
Het oplossen van puur natriumbicarbonaat in water en dit opdrinken is echter af te raden. Bekijk de video van ontzuringstrainer Sylvia Beerens:
Lees meer over natriumbicarbonaat >>

